
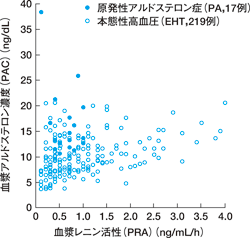
大村 原発性アルドステロン症を発見するために,アルドステロンとレニン活性またはレニン濃度の同時測定が必要なことはおわかりいただけたと思います。 しかし,アルドステロンとレニンの測定値は採血時の食塩摂取量や姿勢,緊張などで大きく変動します。また原発性アルドステロン症は高血圧になりますので, はじめて高血圧を指摘された患者以外の多くの方ではすでに降圧薬が投与されていますが,降圧薬がやはりアルドステロンとレニンの測定値に影響します。 いま日本で最も多く使用されている降圧薬は ACE 阻害薬とアンジオテンシン II 受容体拮抗薬(ARB)ですが, これらの薬剤が投与されている患者ではアルドステロンが低下し,レニンが増加するので ARR が低下し,軽症の原発性アルドステロン症の発見が困難になります。 カルシウム拮抗薬はアルドステロンを低下させ,利尿薬はアルドステロンとレニンを増加させますが, ARR は低下するため原発性アルドステロン症の発見を困難にします。 このようにアルドステロン,レニン,ARR は採血時の種々の条件で大きく変動するため,報告されている ARR のカットオフ値も 18〜50 と大きな差異があります。 したがって,適切なスクリーニング基準を設定することは大変難しい問題です。 図 3 は,初診高血圧患者 236 例の,降圧薬投与前安静臥床 30 分後に採血を行い測定した, レニン活性を横軸にアルドステロン濃度を縦軸にプロットしたものです。 白丸は本態性高血圧,黒丸は原発性アルドステロン症です。 ご覧のように,本態性高血圧でもかなりアルドステロンの高い患者が多く,この傾向はアメリカでの集団検診による調査結果と同様です。 アルドステロンとレニンの測定値が測定条件で変動すること以外に, 原発性アルドステロン症と本態性高血圧でのアルドステロンとレニンが同様な値をとる患者が多数存在する事実も, 原発性アルドステロン症の診断を困難にしている原因かと考えられます。
大村 いろいろ申し上げましたが,約 1,000 人に 1 人しか診断されていない原発性アルドステロン症を少しでも多く発見するため, 高血圧の,とくにはじめて高血圧を診断された患者のアルドステロンとレニンを是非測定していただきたいと思います。 2004 年の高血圧治療ガイドラインでは原発性アルドステロン症を含めた二次性高血圧は,特徴的な所見から疑い特殊検査を行うことを推奨しています。 しかし初診高血圧患者 1,020 例から診断された 60 例の原発性アルドステロン症では, 原発性アルドステロン症に特徴的とされてきた低カリウム血症を合併していた患者は 18%であり, 35 歳以下の若年性高血圧は 3%,高血圧の家族歴のない症例は 39%と,従来二次性高血圧を疑う所見とされていた特徴をもたない原発性アルドステロン症が多かったからです。 ただスクリーニングのためのカットオフ値については,まだ統一した見解がなく,現在日本内分泌学会の原発性アルドステロン症検討委員会で, 日本での簡単に行えるスクリーニング法や確定診断法について検討を行っています。
片山 武田先生の施設では ARR に何か基準を設けていますか。
武田 過去の症例などを検討して 20 というラインでスクリーニングをかけています。施設でばらつきがあっても, とにかく基準をつくって進めていくことが大事ではないかと思います。
片山 降圧薬は大きな問題ですが,ACE 阻害薬や ARB は中止しても 2 週間ぐらいは影響が残っています。 長期にやめてスクリーニングというのも大変で,そこは議論されるべき点ですね。
片山 教えていただきたいのですが,ARR で引っ掛かっても CT で副腎腫大がみつからない場合にどうするのでしょうか。 先生方の施設はカテーテルでサンプルをとられますが, 確定診断にはこういうサンプリングがいるのか,CT などで局在診断がつけばいいのか,あるいはシンチでいいのか。どうなのでしょうか。
大村 非常に難しい問題です。表 1 に,一般外来の初診高血圧患者から診断した原発性アルドステロン症の内訳を示します。 APmacroA とお示しした(1)は,CT などの画像検査で副腎腫瘍が発見され,その腫瘍からアルドステロンが過剰に分泌されている典型的な原発性アルドステロン症です。 このようなCT で診断が容易な典型例は原発性アルドステロン症の 38%と半数にもなりません。 ところが 表 1の(2)で示した原発性アルドステロン症はアルドステロンが片側の副腎から過剰に分泌されていますが, CT では副腎に異常所見がみられない例です。このような微小病変による原発性アルドステロン症が全体の 34%を占め,片側副腎の手術で高率に治癒する可能性があるにもかかわらず, 副腎腫瘍の有無で鑑別を行う従来の診断法では特発性アルドステロン症と診断されて,治癒の機会を逃がしてしまう可能性があります。
さらに問題となるのが,このような原発性アルドステロン症の原因となる微細な病変が存在する副腎の反対側の副腎に, CT で容易に発見可能なホルモン産生のない大きな非機能性副腎腫瘍が存在する例や,手術適応のない特発性アルドステロン症にこのような非機能性副腎腫瘍が合併した場合, 不必要な手術が行われる危険があることです。このような症例が原発性アルドステロン症の約 10%あります。 このように画像検査での原発性アルドステロン症の診断率が 56%とすると(表 1下段), 原発性アルドステロン症の手術適応を決定する確定診断のためには副腎静脈採血が必須の検査と考えられます。 しかしこの検査は術者の熟練が必要であり,すべての医療機関で行うことは事実上困難で,私もどこまでおすすめしたらよいか困っております。
ただ原発性アルドステロン症のスクリーニングが広く行われ,原発性アルドステロン症が多く発見されるようになると, このような画像検査では診断できない微小病変が原因となる原発性アルドステロン症の多くが誤診されないかと心配しております。
| 手術適応 | 症例 | 画像検査の診断 | |
|---|---|---|---|
| (1)APmacroA | ○ | 23 | 1APA |
| (2)APmicroA,UMN,UAH | ○ | 21 | IHA |
| (3)片側微小病変+反対側の腫瘍 | ○ | 5 | APA(反対側) |
| (4)特発性アルドステロン症 | × | 11 | IHA |
| (5)特発性アルドステロン症+片側腫瘍 | × | 1 | APA |
| 手術適応があり手術(1) | 23(38%) | 56%(正診) |
|---|---|---|
| 手術適応がなく薬物治療(4) | 11(18%) | |
| 手術適応があるが手術されず(2) | 21(34%) | 44%(誤診) |
| 手術適応のない副腎が切除(3+5) | 6(10%) |
片山 原発性アルドステロン症は良性の高血圧症という考えが強かったのですが, 多数例を長期フォローすると,高率に脳出血を起こしたり心臓のアクシデントを起こしたりしている。 やはり,見つけたら切るべきものは早く切るというのが原則ですよね。
大村 私もそう思います。アルドステロン産生腺腫は腫瘍の小さい症例のほうが手術後の高血圧の治癒率が高いので, 原発性アルドステロン症でもやはり早期診断,早期治療が重要と考えます。
一方,原発性アルドステロン症は抗アルドステロン薬でアルドステロン作用を抑制し降圧薬で血圧をコントロールすればよいのでは,という考え方もあります。 しかし高アルドステロン血症は臓器障害の原因となり,また抗アルドステロン薬を使用することで血中アルドステロン濃度はさらに増加します。 アルドステロンのミネラルコルチコイド受容体を介さない非ゲノム作用が長期的にどのような悪影響を及ぼすかについてのデータはまだありませんが,危惧される点です。
武田 特発性アルドステロン症の患者で,スピロノラクトンで血圧 130/80 mmHg 以下に 20 年近くコントロールしてきたのですが,最近,狭心症が起きて冠動脈造影をしたところ, 多枝にわたり動脈硬化がかなり進んでいるという症例を経験しました。こういう経験はほかの先生方もおもちではないでしょうか。 このことは非常に重要な問題で,抗アルドステロン薬で合併症が完全に抑えきれるかどうか,きちんとデータを出していかないといけないと思います。
武田 二次スクリーニングについてはいかがでしょうか。
大村 原発性アルドステロン症の二次スクリーニング検査にはいろいろな方法が提唱されています。
欧米では,生理食塩水負荷試験がゴールドスタンダードとされていますが,生理食塩水 2 リットルを 2 時間で点滴するという検査であり, 重症高血圧や心不全を合併している患者にはなかなか行えない検査です。
最近,これに代わる検査としてカプトプリル負荷試験が生理食塩水負荷試験と同等の感度,特異度をもつと報告されています。 また日本では,従来からフロセミド−立位試験が行われています。 フロセミド−立位試験はカプトプリル負荷試験と比較して,感度,特異度がやや劣りますが,原発性アルドステロン症の診断で重要なレニンの抑制を判定する優れた検査と考えています。
武田 最近の厚労省のホームページでは,フロセミド−立位で 2 時間後のレニン値が1.0 ng/mL/時以下というのが出ていますが。
大村 原発性アルドステロン症のなかにはフロセミド−立位試験でレニン活性が 1.0 ng/mL/時以上に増加する例もかなりあり,カットオフ値の再検討は必要ですが, レニン分泌が抑制されているというのは原発性アルドステロン症診断上非常に重要な条件であると思います。
片山 片側性多発副腎皮質微小結節(UMN)と微小腺腫は画像診断でみつからない。 そうすると,サンプリングができない施設では次にどうしたらいいのでしょうか。
大村 私たちが新たな原発性アルドステロン症の原因疾患として報告しました UMN ですが,最初は特発性アルドステロン症ではないかと診断していました。 しかし副腎静脈採血検査を行うと,画像上明らかな腫瘍がないのに, 副腎静脈血中アルドステロン濃度が左右で大きく異なっていました。そこで手術を行ったところ,切除した副腎に微小結節が多発していました。 その後詳しい病理検査を行ったところ,特発性アルドステロン症とは異なる病理所見であることが判明しましたし, 特発性アルドステロン症では片側副腎を切除しても血圧は正常化しませんが,この症例では術後血圧が正常化しました。
この症例がきっかけとなり,原発性アルドステロン症が強く疑われるが画像検査で腫瘍が発見できない症例であっても, すぐに特発性アルドステロン症と診断せずに,必ず副腎静脈採血検査を行い,アルドステロンの過剰分泌が両側性なのか片側性なのか, そして片側性ならば右側か左側かを検討したところ,アルドステロン産生腺腫も約半数がCT で診断できないことが判明しました。
片山 右がうまく入らずサンプリングができなかったのですが,シンチはしっかりあって, CTでは不明というような症例を手術したことがあります。 ところが,アルドステロン産生腫瘍のカナリヤ色の腫瘍が見られない。 病理の方は連続で切ってくれないので,正常副腎という答えが返ってきて,困ってしまって切り直していただいたら,小さいのがあった。 こういうのを 2 例続けて経験しました。誤診したのではないかと,ストレスです。
大村 片山先生のおっしゃるように,画像検査で腫瘍のない副腎を切除することは本当に大きなストレスです
片山 先生にもどんどん症例を報告していただき,広くコンセンサスをつくっていただければと思います。
大村 いままで高血圧症というと本態性高血圧症か腎性高血圧症ということで,鑑別診断をしてもほとんど治せませんでした。 しかし,原発性アルドステロン症は治る。診断は改良して簡便化していかなければいけませんが, 治せる患者が 200 万人もいると考えると,これは無視するべきではありません。高血圧症患者を 200 万人減らせれば国民医療費がどれだけ減るか。 この観点からもきちっと診断していくことが大事だと思って,診断の簡便化に努めています。