 |
 |
 |
| RDPの論拠 (The
Rationale for RDP) |
 |
 |
 |
 |
| ■□■ |
医薬品の使用とコストの評価 |
|
| |
(Assessment of Drug Utilization and Costs) |
■□■ |
 |
 |
 |
診断,治療,予防のために承認される医薬品の数は毎年増加し続けており,その初期の価格は急激に上昇した。1986年から1987年にかけてのPharmacareの予算は1億6千5百万カナダドルであった。1995年から1996年までは,4億660万カナダドルであり,保健省全体の予算66億カナダドルの6%を占め(図2),9年間でほぼ250%の増加であった。この中には,病院での医薬品や,消費者から直接支払われた金額は含んでいない。
1990年から1994年にかけてRDP設立直前には,Pharmacareの医薬品のコストは毎年15%という耐え難い上昇率であった。これは予想できない伸び率であった(図3)。それに加え,連邦政府からの支払いが減額されるという恐れがあり,予算修正のために改革的なアプローチが必要とされた。
Pharmacareは,包括的な医薬品保障を継続するために,その経費を最優先した。1994年まで,Pharmacareの医薬品リストはカナダで販売が承認されているほとんどの薬を含んでいた。医薬品審議のより厳格な審査がその年に始められた。この審査の主な目的は,受取人の利益のために薬がPharmacareプログラムにより保障の対象に含まれるべきかを判断することだった。
この間に,Pharmacareの予算増加の要因についてのある独立団体のリサーチ33)が注目を浴びた。そこでは,Pharmacareの主な問題点をあげ,またPharmacareの見通しを評価したからである。コスト増加の34%は,新薬が開発されたことと,古い薬の価格の上昇によるものであり,高齢化と医薬品使用の増加とは関係がないと結論付けた。また,既存の同種同効薬になりかねない新薬やそれによりもたらされる新たなコスト上昇を避けるための対策を指摘した。
これらの評価から,医薬品のコスト上昇の原因は,医薬品の使用や価格傾向に関する統計に表れない要因もあり,また,情報公開した予測が貴重であるということがわかった。
 |
図3 他の指標と比較したPharmacareの支出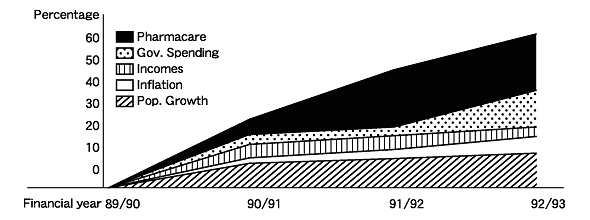
|
 |
 |
 |
 |
| ■□■ |
実行可能な介入の査定 |
|
| |
(Assessment of Potential Interventions) |
■□■ |
 |
 |
 |
Pharmacareのベネフィットプログラムのレビューについて,幅広い公聴会におけるパネル・ディスカッションが1993年に開かれた。このパネル・ディスカッションでは,経済力のある患者は年齢にかかわらず,医薬品のコスト負担に協力するべきであるとした。また支払い能力に応じて,高齢者,長期治療患者,生活保護受給者,高額医療世帯のプランを,統括した医薬品プランに変更することを提案した。これを実行するにあたっての政策上の異議は,Stephen
Soumerai氏が1994年に医薬品コスト規制プログラムの影響についての研究発表をPharmacare で行っている34)。彼は,わずかな自己負担(co-payment)でも患者が必要な薬の服用を中止する原因になると強調した35)。
一律の自己負担の代わりに,Pharmacareは,少なくとも一種類の必須薬について全額保障し,同種の高額医薬品の差額については自己負担を請求するという案を出した。これについての最初の試みは,一般薬代替(generic
substitution,ドイツのReference Pricing, Stage Iとして知られている18))に類似した低価格代替プログラム(Low
Cost Alternative Program: LCA)というものであった。LCAは,同種同効薬が他の会社により提供される場合は,Pharmacareは同種同効薬の最低価格を補填するとした。このポリシーの実施以前には,地域の薬剤師は,すでに医薬品の金額を直接支払った患者には日常的に,後発医薬品を調剤していた。
州の法律では,科学的に同一な後発医薬品への代替を許可している。LCAプログラムは,これをPharmacareにより医薬品の金額が支払われている患者についても適用した。また患者には,代替の薬のために患者自身がそのコストを支払うオプションもある。LCAにより,初年度に約2千万カナダドルを節減し,年間の節減額は追加された新薬の特許保護が解除されるまでに及んだ。この方法は地域および病院薬剤師にとって通常の行為であり,LCAを支持するための文献などは必要とされなかった。このように,健康に対するポリシーの評価は必要とされなかった。
2つ目の試みは,新薬の医学的効果について発表されたエビデンスの内容を審査する治療薬イニシアティブ(Therapeutics Initiative: TI)を設置したことだった36)。TIは医薬品リストに掲載するかについて審議するため,Pharmacareの医薬品評価委員会に新薬の治療効果についての評価内容を提出する。Pharmacare
は,医師がエビデンスにもとづいた処方ができるように教育する目的でTIに資金援助したが,成果はコスト削減のために不十分であった30)。TIは,ブリティッシュコロンビアのすべての医師に,既存薬の比較効果のレビューを配布した。
1995年に,Pharmacareは,LCAの理論を,公表されたエビデンスにしたがって治療上同等の効果があるとみられる同分類の薬品に適用した(ドイツのReference
Pricing, Stage IIとして知られている)18)。1995年までにここでの参照価格は,オランダ,デンマーク,ニュージーランドで使用され,イタリアはこれを採用する計画があると公表した。それぞれの国で異なるアプローチがあるが,価格の低減に効果があったとされている17,18,37)。医薬品業界は,医薬品全体の価格上昇のため,ヨーロッパではこのポリシーは効果がないと反論した。しかし,医薬品業界の意見を証明する,発表されたエビデンスはなく,個人的に未発表の資料が入手できる程度である。ニュージーランドの保健省大臣代理は,1990年代初期にブリティッシュコロンビアの保健省の官僚であり,しばしばブリティッシュコロンビアを再訪していた。したがって,Pharmacareはどのようにニュージーランドが参照価格の導入の初年に3千万カナダドルを削減したか学んだのである38)。
RDPを支持する直接のエビデンスはまだ正式に公表されていないが,病院での長年にわたる処方集作成における標準的類似性から,多くのエビデンスがあった。病院の処方集は,入院患者にその時点における標準的治療を提供するために,薬物治療学委員会を通して,病院の医療スタッフにより考案された医薬品リストある。地域で一般に使用されている医薬品は,病院の処方集に掲載されていないことがある。処方集に掲載されている薬が患者個人に適切でないとき,また治療効果が得られないときは,処方集に掲載されていない薬を処方されることがある。これは,ブリティッシュコロンビアにおいて特別な権利を有したRDPとまさに類似している。処方集は病院での,適正で対価格に見合った薬物治療を確実に実施するための治療標準だと考えられている。このように,RDPは,医薬品プランにおいて治療標準になる可能性が高い。
薬の効力と効果についての研究は莫大であるが,医薬品ポリシーへの影響についての研究はごくわずかであることがこれらの評価の過程からわかった。エビデンスにもとづいたポリシーメイキングがさらに必要である。
 |
 |
 |
| ■□■ |
ポリシーの選択 (Policy Choices) |
■□■ |
 |
 |
 |
RDPが方策として決定されたことに伴い,主な戦略が必要となった。どの分類の薬から着手するか,また,それぞれの分類のどの薬が参照薬品として選択されるかである。RDPの治療分野は次の基準を満たした領域が選択された。
- 患者のケアにおいて,ポジティブまたはニュートラルな治療効果がなければならない。
- Pharmacareのスタッフが効率よく運営できるものでなければならない。
- 明確で実行可能な特別権利プロセスをもっていること。
- 州の医薬品の支出を顕著に削減する可能性があること。
- 信頼のおける科学的エビデンスにもとづくこと。
これらの基準を満たすことに加え,最初の3つの薬品の分類は比較的わかりやすく,実行が容易であるとされた。たとえば,胃酸抑制薬(H2RAs),狭心痛の硝酸薬,主に関節炎に使用される非ステロイド性抗炎症薬
(NSAID)である。H2RAsとNSAIDsには医学的効果の比較について発表された多くのエビデンスがある。硝酸薬の異なる剤型を比較した試験結果についての発表はないが,これは医師や製薬会社がそれらの効力の違いは微量,または皆無であると考えている。初年の3千万カナダドル削減の見積りは,これらの選択に影響を与えた。
病院の処方集の臨床経験にもとづく,他の戦略の決定内容は,患者に無効あるいは副作用の際に速やかに特例を認める特別権利についてであった。これはRDPを他の国の価格参照システムより融通のきくものにした。RDPが審議される以前にPharmacareは,個々の患者の処方箋をオンラインで記録するように,ブリティッシュコロンビアのすべての薬局と主要コンピュータをつなぐシステムPharmaNetに資金援助した。法律により,州内の薬局で処方されたすべての薬はPharmaNetに記録されることが義務付けられている。最初のRDPは,PharmaNetがすべての薬局で作動するようになった2週間後の1995年10月1日に実施された。PharmaNetシステムは,患者の受給状況,自己負担,現在の控除額を迅速に通知することでRDPの実施を助けた。このシステムは,医師や患者が記憶できないような複雑な規定や,さまざまな例外を処理する助けとなった。たとえば,PharmaNetは患者がすでに服用している薬と相互作用のある参照医薬品や症状が悪化する可能性のある薬を自動的に除く際に使用された。
これらの決断から,発表された研究は,ポリシーメーカーにどの分類の薬から着手する選択に役に立ったが,研究は,ポリシーの選択の戦略や時期について,またPharmaNetがどのようにポリシーの実施に使用されるかなど,多くの質問には適切ではないということがわかった。これら適合性の欠如は,専門知識は政治的決断には必要としない,と感じている研究者との共同研究には何らかの妨げとなった。
|