ポリシーについての概要が保健省と内閣に承認された後,ポリシーの詳細な実行にむけて性急な作業が始まった。専門家委員会が,実施に向けてPharmacareの責任者に助言をするために召喚された。医薬品参照プログラム諮問委員会(RDP
Advisory Committee: RDPEAC)は,医師,薬剤師,エコノミスト,薬理学者により構成され,治療におけるコスト削減プログラムの専門知識のあるわれわれの1人(R.S.N)と病院の薬剤師が議長を務めた。RDPEACは,分類された薬のためにどのようにRDPを実施するかについてアドバイスを与えるよう要請された。委員会の最初の提案は,RDPは段階を追って実施されるべきであるとの意見だった。このようにRDPは,最初の3つのカテゴリーの薬は同時期にではなく,何ヵ月もかけて適用された。その後のアプローチは,多くの細かいポリシーの選択がそれぞれのカテゴリーに残っていたため,委員会とPharmacareには困難な作業であった。たとえば,どの薬が参照医薬品の最終選択になるか,毒性や無効と認められた場合,一部補填の分類から除外されるべきか,どの基準が免除として記されるべきか,どの医学専門領域が免除されるか,どの補助的なポリシーがRDPの成功のために必要か,などである。
新しい医薬品が分類され,研究される時に,RDPEACはRDPに加えるためのエビデンスを収集した。欠点や利点をまとめるなど,前回の反省を生かして次の実施が試みられた。
 |
 |
 |
| ■□■ |
最初の試み (The First Plunge) |
■□■ |
 |
 |
 |
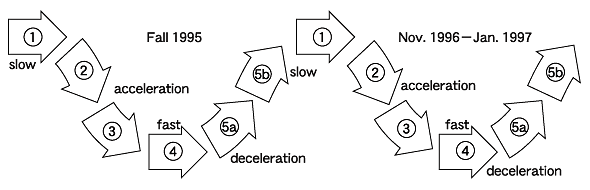
RDPEACは,ポリシーサイクルに初期の段階から加わった。図4は,ポリシーサイクルのローラーコースターのごとく激しい変動を表している。ステップ1と2では緩やかであり,ステップ3で加速し,ステップ4で急進しステップ5で減速している。この変動は新しい分類の薬をRDPに含めるべきかを審議する際に明らかに認められた。
 |
図4 ポリシーサイクルの変動
| ブリティシュコロンビア州のReference Drug Programの実行,1995-1999年はポリシーメーカーと研究者達との間でローラーコースターのように変動した(数字は図1のポリシーサイクルの段階に対応する)。 |
|
 |
 RDPは,ヒスタミン2受容体拮抗薬 (H2RA)から始まった。これらの薬は,消化性潰瘍や胃食道逆流症に適用され,胃腸の状態を整えるために使用される。ブリティッシュコロンビアでは,当時4種類のH2RAがそれぞれ異なる価格で入手可能であった。それらは,シメチジン(4.2カナダドル/月),ラニチジン(13.2カナダドル/月),ファモチジン(22.5カナダドル/月),ニザチジン(28.2カナダドル/月)39)である。RDPEACは,これらすべてを医学または薬理学的な文献をもとに,有効性と安全性について同等であると判断した40)〜43)。このエビデンスは,医師へのこのポリシーについてのPharmacareの手紙に引用された。最も低価格なシメチジンは,参照医薬品になった。オメプラゾール(69カナダドル/月)は,プロトンポンプ阻害薬に分類され,より効果的な胃酸抑制薬として知られているが,当時は長期間の安全性は確立されていなかった。このため,オメプラゾールは,H2RAのように参照医薬品にはなかったがポリシーの一部になった。
RDPは,ヒスタミン2受容体拮抗薬 (H2RA)から始まった。これらの薬は,消化性潰瘍や胃食道逆流症に適用され,胃腸の状態を整えるために使用される。ブリティッシュコロンビアでは,当時4種類のH2RAがそれぞれ異なる価格で入手可能であった。それらは,シメチジン(4.2カナダドル/月),ラニチジン(13.2カナダドル/月),ファモチジン(22.5カナダドル/月),ニザチジン(28.2カナダドル/月)39)である。RDPEACは,これらすべてを医学または薬理学的な文献をもとに,有効性と安全性について同等であると判断した40)〜43)。このエビデンスは,医師へのこのポリシーについてのPharmacareの手紙に引用された。最も低価格なシメチジンは,参照医薬品になった。オメプラゾール(69カナダドル/月)は,プロトンポンプ阻害薬に分類され,より効果的な胃酸抑制薬として知られているが,当時は長期間の安全性は確立されていなかった。このため,オメプラゾールは,H2RAのように参照医薬品にはなかったがポリシーの一部になった。

| ポリシーとは何か?(What Was the Policy?) |
ポリシーでは,「H2RAまたは継続中の処方薬はシメチジンの価格まで支払われる」と明記した。ポリシーの補足には,医師がH2RAの使用を制限し,オメプラゾールを使用するかもしれないという懸念が紹介された。オメプラゾールを使用する新しい処方箋は,消化器専門医の処方箋または,6週間から8週間にわたるH2RAの使用の結果,治療効果がなかったことを明記する必要があるとした。特に消化器専門医からの処方箋は,オメプラゾール全額を保障したが,これは,H2RA
が他より優れているとの正当性はなかったため,H2RAの制限の免除ではなかった。すでにオメプラゾールまたはH2RAを服用している患者への免除はなかったが,ポリシーが実施される前に,これらの薬を無制限に服用を避けるため8週間の猶予期間が与えられた。
上記の服用患者のためのポリシー適用の延期は,研究者が諮問委員会に関与したことの結果であった。われわれの1人(M.M)は,現在1万人のオメプラゾールの服用患者と,毎年1万人の新しい服用患者がいると確証した。これは,特別権利による1日あたり50から100の要請が殺到する可能性があることを意味し,Pharmacareは対処する準備ができていなかった。特別権利は,特別な状況において,医師が非参照薬をPharmacareによって全額保障されるよう要請ができるようにした。患者は,服用している薬が,シメチジンとワーファリン,フェニトイン,テオフィリン,シクロスポリンなど,医学的に重度の相互作用があると認められれば,免除が認められた。また患者は,代替薬とシメチジンとの差額を支払うかの選択が与えられた。特別権利は,要請されたパターンの傾向を研究者とポリシーメーカーが共同で分析する機会を与えた。
 ポリシーは,医薬品業界からの好ましくない宣伝の引き金となった3)。薬剤師らは,不慣れなPharmaNetシステムの採用と同時に,患者と医師ら双方にRDPについて説明を行う負担について不満をもらした。また医師らは,処方箋についての権限が脅かされると感じた44)。当初,多くの医師らは,エビデンスが示されているにもかかわらず,最も低価格なシメチジンは,他の非参照薬より劣っていると信じていた。ポリシーは患者の健康に悪影響を与え,価格変化をもたらした,と批判した。これらの批判を支持するエビデンスはなかったが,ポリシーは偶発的な結果ではないと信じた。これは,内科的,外科的,薬物治療における決断が偶発的な結果であると主張する,不合理な意見であった。
ポリシーは,医薬品業界からの好ましくない宣伝の引き金となった3)。薬剤師らは,不慣れなPharmaNetシステムの採用と同時に,患者と医師ら双方にRDPについて説明を行う負担について不満をもらした。また医師らは,処方箋についての権限が脅かされると感じた44)。当初,多くの医師らは,エビデンスが示されているにもかかわらず,最も低価格なシメチジンは,他の非参照薬より劣っていると信じていた。ポリシーは患者の健康に悪影響を与え,価格変化をもたらした,と批判した。これらの批判を支持するエビデンスはなかったが,ポリシーは偶発的な結果ではないと信じた。これは,内科的,外科的,薬物治療における決断が偶発的な結果であると主張する,不合理な意見であった。
 批判に対処するためには,薬の分類ごとにRDPを計画的に実行させることであった。これには,それぞれの専門家グループの討論に時間をかけ,エビデンスにもとづく情報交換の準備,批判者への対応,Pharmacare
スタッフによる手続き上のトラブルシューティングを必要とした。さらにRDPの将来のために,豊富な経験と,実施に対する査定を要した。2番目の習得内容は,ポリシーは17万4千の処方箋を,ラニチジン,他のH2RA,オメプラゾールからシメチジンに,有害反応の報告もなく変えたことである。これは,Pharmacareの1996年から1997年の年間予算4億ドルのうち,約1200万カナダドルの削減になった。
批判に対処するためには,薬の分類ごとにRDPを計画的に実行させることであった。これには,それぞれの専門家グループの討論に時間をかけ,エビデンスにもとづく情報交換の準備,批判者への対応,Pharmacare
スタッフによる手続き上のトラブルシューティングを必要とした。さらにRDPの将来のために,豊富な経験と,実施に対する査定を要した。2番目の習得内容は,ポリシーは17万4千の処方箋を,ラニチジン,他のH2RA,オメプラゾールからシメチジンに,有害反応の報告もなく変えたことである。これは,Pharmacareの1996年から1997年の年間予算4億ドルのうち,約1200万カナダドルの削減になった。
第3の点は,エビデンスにもとづいたポリシーは,ポリシー実施直前だけではなく,医薬品製造業者,医師,住民からの批判に対応した後も役に立ったということである。ポリシーは,患者への影響を証明せずに作成されたとの批判に対応するため,外部の研究者,ポリシーに批判的な医師を含んで,われわれの1人(B.C.C)が議長を務める評価分科委員会が設立された。委員会の目的は,RDPの影響に関する評価を審議し,モニタリングされているRDPのポリシーの質と効果を監査することだった。
第4の点は,ポリシーメーキングのプロセスについて研究している研究者ら45)が,H2RAのRDPを実施する直前まで予想されなかった数々の細かい問題があることに驚かされたことである。これらの日程表にぎっしり詰まった障害は,委員会のメンバーの討論だけではなく,エビデンスを省みるなどの時間がなかった。ポリシーの実施について,短時間に専門家の意見にもとづいてさまざまな決定が下されなければならなかった。
また住民,医師,製薬会社からの批判に対応することは,時間を費やすことである。これには,エビデンスの不足によりポリシーの進展を妨げることがない範囲で,プロセスを進めながら学んでいくというアプローチが必要であった。したがって,われわれの決断はポリシーの実施であり,さらに次の段階のために査定をし,正式な評価ができるようなポリシーの評価基準を決めることだった。

| 疑問点 (Questions That Remained) |
RDPの実施の初期段階で,Pharmacareは大きな障害に遭遇した。それは,どのようにして,エビデンスにもとづくわれわれのポリシーを,より効率のよい実施のために保険金監査者らに伝達するか,という点であった。もしこの理由が明確にすることができれば,それは反対意見を減らし,支持を得ることができ,また政策を考案することができる。ブリティッシュコロンビアの医師らにエビデンスにもとづいた情報だけを吸収させるというのは難しい問題であったが,われわれの研究はすぐにそれを確認した30)。
 |
 |
 |
| ■□■ |
プロセスの速度 (The pace quickens on the straightaway) |
■□■ |
 |
 |
 |
次のRDP実施の2段階目は,心疾患に使用される硝酸薬と関節炎に使用されるNSAIDが同じ時期に実施された。硝酸薬は,3つの経路により使用できる。経口,局所剤,経皮による方法である。イソソルバイド亜硝酸薬(ISDN)は経口により服用され,最も低価格の薬である(4.62カナダドル/月)である。ニトログリセリン塗布薬は,ニトログリセリン経皮パッチより不便であるといわれているが,比較的低価格である(塗布薬=19.4カナダドル/月,経皮パッチ=60.4カナダドル/月)。
 当時,硝酸薬の代替の効力を比較する無作為化比較試験はなかった。プラセボ比較試験は地域の専門家によって検討された46,47)。これらのレビューにもとづきRDPEACは,硝酸薬が他の硝酸薬比べて治療上の利点があるとの証拠は不十分であるとした。治療上の利点を証明するために,十分な金銭上の報酬を製造業者に提供できるとすれば,すべての剤型における硝酸薬の治療上の効果は同等であると考えることができる。委員会は経口硝酸薬を処方されている患者は,ISDNに変更し,経皮ニトログリセリンを処方されている患者はニトログリセリン塗布薬に変更するよう提案した。
当時,硝酸薬の代替の効力を比較する無作為化比較試験はなかった。プラセボ比較試験は地域の専門家によって検討された46,47)。これらのレビューにもとづきRDPEACは,硝酸薬が他の硝酸薬比べて治療上の利点があるとの証拠は不十分であるとした。治療上の利点を証明するために,十分な金銭上の報酬を製造業者に提供できるとすれば,すべての剤型における硝酸薬の治療上の効果は同等であると考えることができる。委員会は経口硝酸薬を処方されている患者は,ISDNに変更し,経皮ニトログリセリンを処方されている患者はニトログリセリン塗布薬に変更するよう提案した。
ポリシー実施の時期に,20種類以上のNSAIDがカナダで普及していた。今日の医学または薬学文献によると48〜52),副作用については異なるものの,すべてのNASAIDは同等の治療効果があると判定された。これらの薬の月間の治療コストの違いは,低量のアスピリンの2.1カナダドルから新しいNSAIDの80カナダドルの範囲であった。硝酸薬のケースと同様にNSAIDの効果の比較についてわずかな臨床試験しか発表されていなかった。これらの試験であるNSAIDが他のNSAIDより優れているという一貫した証拠は認められなかった。この硝酸薬とNSAIDに関してのエビデンスは,Therapeutic
Initiative によって次の12ヵ月の間に,処方している医師らに広く伝えられた。

| 2つのポリシーの意味(What Were These Two Policies?) |
硝酸薬のポリシーは,1995年11月1日に発表された。それは,すべての新しい薬と継続の経口硝酸薬の処方箋は,後発のISDN(4.62カナダドル/月)の金額まで補填されることと,また局所剤の硝酸薬についてはニトログリセリン塗布薬(19.4カナダドル/月)まで補填されることを記した。特別権利は,参照医薬品を使用できない者,認知機能障害,身体障害のあるものに適用された。循環器病専門医に対して免除は承諾されなかった。
NSAIDに関するポリシーは,新しい処方箋または,継続の処方箋は後発のナプロキシン(13.45カナダドル/月)の金額まで補填されることを記し,1995年11月27日に実施された。患者がより高額のNSAIDを必要としているという医師の理由は特別権利の適用に値しなかった。ポリシーは,患者が参照医薬品のNSAID(またはアセトアミノフェン)を使用し,それが効果ないと認められた時のみ,特別権利が適用された。しかし,リウマチ関節炎,強直性脊椎炎,痛風患者には医師の要請によって自動的に特別権利が適用された。リウマチ専門医,歯科医師も対象外であった。
 11月の2つのポリシー実施から,2ヵ月足らずで反対意見は益々増加の一途をたどった。1995年12月18日に,カナダ製薬工業協会(PMAC)とそれに属する7つの会社は,司法長官を相手取り,保健省大臣とPharmacareがすべての参照医薬品のポリシー実施を停止することを求めブリティッシュコロンビアの最高裁判所に告訴した(州の高等裁判所と控訴裁判所では政府の勝訴を認め,その告訴は1998年2月にカナダの最高裁判所で棄却された)。
11月の2つのポリシー実施から,2ヵ月足らずで反対意見は益々増加の一途をたどった。1995年12月18日に,カナダ製薬工業協会(PMAC)とそれに属する7つの会社は,司法長官を相手取り,保健省大臣とPharmacareがすべての参照医薬品のポリシー実施を停止することを求めブリティッシュコロンビアの最高裁判所に告訴した(州の高等裁判所と控訴裁判所では政府の勝訴を認め,その告訴は1998年2月にカナダの最高裁判所で棄却された)。
この状況に伴い,さまざまな監視人からの鋭い批判が続いた。ヘルスプロフェッショナルの中には,ポリシーは患者のケアを損ね,疾患の増加に導き,患者のケアに関する全体のコストを増加させたと非難する者もいた。医薬品製造業者は,研究に投資した会社を差別待遇し,提案された削減案は医療サービスの需要の増加と,増加する入院患者のため,実行不可能であるとした。また他の者は,ポリシーはカナダのヘルスケアシステムを2層構造へ導いたと述べた。
しかし,州の高齢者からはポリシーを支持する声があった。それは,政府はコストの管理をヘルスケアの質について妥協することなく行ったとするものであった。これらのデータは,Seniors
Drug Focus Project(下記の「評価」参照)の電話によるインタビューにより集められた。当時,準備段階の評価において省のアナリストは,RDPポリシー実施によって他のヘルスサービス使用の増加はなかったと発表した。
 最初の3つの医薬品類(H2RAs,硝酸塩,NSAID)にRDPを適用したことによってPharmacareが得た削減額は,年間2500万カナダドルであった53)。ある医薬品会社によって作成された対策案の特筆すべき結果は,経皮ニトログリセリンを競合相手会社の32%の価格で,また参照医薬品価格と同じ価格で販売したことであった。この価格はRDPプログラムによって独自に決断されたものと批判されたが,その時期と価格の一致から,その指摘は考えにくい見方であった。専門家や開業医がある特定の硝酸薬を必要とする医学的根拠がないため,硝酸薬のポリシーを進めるに際して循環器病専門医や一般開業医への相談は必要ないとされた。
最初の3つの医薬品類(H2RAs,硝酸塩,NSAID)にRDPを適用したことによってPharmacareが得た削減額は,年間2500万カナダドルであった53)。ある医薬品会社によって作成された対策案の特筆すべき結果は,経皮ニトログリセリンを競合相手会社の32%の価格で,また参照医薬品価格と同じ価格で販売したことであった。この価格はRDPプログラムによって独自に決断されたものと批判されたが,その時期と価格の一致から,その指摘は考えにくい見方であった。専門家や開業医がある特定の硝酸薬を必要とする医学的根拠がないため,硝酸薬のポリシーを進めるに際して循環器病専門医や一般開業医への相談は必要ないとされた。
NSAIDのポリシーが実施される前の,医師や薬剤師に与えられた事前報告の期間(17日間)は関係者に不満を感じさせた。このため薬局が非参照医薬品の過剰な在庫をもつことになり,また医師,薬剤師,患者は,ポリシーの性急な変更に対応しなければならなかった。これらのことから,われわれはその後のポリシーについて十分な時間を与えることを確認した。
多くの患者がRDPポリシーの参照医薬品の臨床試験に適応できなかったため,特に理学療法医,リハビリテーション専門家などの医師がNSAIDへの容易なアクセスが必要であることも判明した。これらの専門家はポリシーの免除を認可された。

| 今後の課題(Questions That Remained) |
2つの解決すべき重要な問題が残っている。第1に十分な時間をかけ保険金監査者に内容を通達するなど,どのようにRDPの実施を合理化するかである。これは参照医薬品に患者を移行できるようにすることと,非参照薬品の過剰な在庫をなくすことを目的としている。第2に,医師が特別権利適用の申請を出す前に,どのように患者にRDPの医薬品の使用を促すかということである。
 |
 |
 |
| ■□■ |
予測される問題(Anticipating the Bumps) |
■□■ |
 |
 |
 |
降圧薬についてのRDPの実施は,1996年10月15日に告知された。安全性が立証されている効果的な高血圧治療を促進するために,同分類の中で大きな価格の格差があるにもかかわらず,RDPEACはβ遮断薬と利尿剤をRDPに含めないことに決めた。
 RDPEACは,第2次選択薬,特にアンギオテンシン変換酵素阻害薬(ACEIs)やジヒドロピリジン系Ca拮抗薬(CCBs)についてのみポリシーに適用されると決断を下した。これらの分類の中で,合併症のない高血圧に使用された場合,これらの種類内の薬物間には有効性や安全性に医学的に大きな違いはないと広く知られていた。collaborative
group of ACE inhibitor trials のメタアナリシスではACEIの間でいくらかの相違を示したが,一つの成分がその分類全体の効果を左右するほどではなかった54)。
RDPEACは,第2次選択薬,特にアンギオテンシン変換酵素阻害薬(ACEIs)やジヒドロピリジン系Ca拮抗薬(CCBs)についてのみポリシーに適用されると決断を下した。これらの分類の中で,合併症のない高血圧に使用された場合,これらの種類内の薬物間には有効性や安全性に医学的に大きな違いはないと広く知られていた。collaborative
group of ACE inhibitor trials のメタアナリシスではACEIの間でいくらかの相違を示したが,一つの成分がその分類全体の効果を左右するほどではなかった54)。

| ポリシーとは何であったか?(What Was the Policy?) |
降圧薬のためのRDPのポリシーは1997年1月から実施され,下記の内容であった。
- カプトリル,ラミプリル,キナプリルを,ACE阻害薬の参照医薬品にする。これらの薬のすべての剤型について27カナダドル/月まで全額保障される。
- フェロジピンはCCBの参照医薬品であり,すべての剤型について31カナダドル/月まで全額保障される。
循環器病専門医,腎臓病専門医,内科専門医は,喘息や糖尿病患者と同様に,ポリシーから除外されていた。ベラパミル,ジルチアゼムなど,後発の徐放製剤は政府の一般代替品に関するポリシーにより保障された。
 降圧薬のRDPのポリシー実施告知は,大きな反対を呼んだ。それはカナダ循環器学会55)の論文により,攻撃の矢面に立たされた。多くの抗議の中で,その論文は,RDPは患者のケアに妥協をし,ブリティッシュコロンビアの住民の健康を脅かし,治療の状況を無視したと述べた。しかし,3人の著名なヘルスケアと疫学専門家から編集者へ宛てた手紙の中では「論文は,多くの不正確な点があり,限られた文献しか使用せず,また参加者の名前が記されていない。さらに背景事情を述べた論文はRDPのポリシーの評価員として利害関係をもつ医薬品業界の2名によって出版されている」56)と強調されていた。後に公共フォーラム(RDPの降圧薬のポリシーに関連する医薬品製造業者によって資金援助を受けた)の議長を務めたその著者は,さらにポリシーは患者にとって不利益だと非難した。医薬品業界とつながりのある反対運動グループは,ブリティシュコロンビア・ファーマケア改善連合(British
Columbia Better Pharmacare Coalition)を結成した。その目的はRDPに反対することだった。その組織は,RDPは短期の予算削減の名目で良質の医療ケアを犠牲にしたとし,RDPの評価が出されるまで一時停止を求める動きを支持した。この考えは,新聞への投書,ラジオ解説を通して広められ,また政治担当者と,Internal
Medicine Specialists of Nanaimo BC, First Association of Nephrologists of British
Columbia, British Columbia Pharmacy Associationの担当者との会議が行われた。
降圧薬のRDPのポリシー実施告知は,大きな反対を呼んだ。それはカナダ循環器学会55)の論文により,攻撃の矢面に立たされた。多くの抗議の中で,その論文は,RDPは患者のケアに妥協をし,ブリティッシュコロンビアの住民の健康を脅かし,治療の状況を無視したと述べた。しかし,3人の著名なヘルスケアと疫学専門家から編集者へ宛てた手紙の中では「論文は,多くの不正確な点があり,限られた文献しか使用せず,また参加者の名前が記されていない。さらに背景事情を述べた論文はRDPのポリシーの評価員として利害関係をもつ医薬品業界の2名によって出版されている」56)と強調されていた。後に公共フォーラム(RDPの降圧薬のポリシーに関連する医薬品製造業者によって資金援助を受けた)の議長を務めたその著者は,さらにポリシーは患者にとって不利益だと非難した。医薬品業界とつながりのある反対運動グループは,ブリティシュコロンビア・ファーマケア改善連合(British
Columbia Better Pharmacare Coalition)を結成した。その目的はRDPに反対することだった。その組織は,RDPは短期の予算削減の名目で良質の医療ケアを犠牲にしたとし,RDPの評価が出されるまで一時停止を求める動きを支持した。この考えは,新聞への投書,ラジオ解説を通して広められ,また政治担当者と,Internal
Medicine Specialists of Nanaimo BC, First Association of Nephrologists of British
Columbia, British Columbia Pharmacy Associationの担当者との会議が行われた。
 この段階で,われわれは,どのように評価が批判を静めたかについて多くを学んだ。RDP 評価委員会 は保健省の外部の研究者から提出されたRDPの評価案のためのレビュープロセスを設けた。われわれはこの時期に,研究がポリシーメーキングのプロセスに影響すること,またポリシーメーキングが研究に影響することを明確に表現するために,研究者と方針決定者との信頼関係を築くようさまざまな努力をした。両者の医薬品からのコスト削減の概算は,年間1400万カナダドル/月(CCB=900万カナダドル/月,ACE抑制剤=500万カナダドル/月)であった。RDPが拡大されるにつれて,反対者からの圧力は増加することは明らかだった。その内容は,ポリシーは不利益であり,削減の概算は達成できないという主張だった。この圧力は,批判者への対応に要する時間を増加させ,ポリシーの実施と開発,また実施のための対策を考案する時間を減少させた。特別権利適用の要請は,1日に300から400送られてきた。医師からの主な批判は,SAフォーム記入やファクス送付など,無報酬の作業が増加したということだった。
この段階で,われわれは,どのように評価が批判を静めたかについて多くを学んだ。RDP 評価委員会 は保健省の外部の研究者から提出されたRDPの評価案のためのレビュープロセスを設けた。われわれはこの時期に,研究がポリシーメーキングのプロセスに影響すること,またポリシーメーキングが研究に影響することを明確に表現するために,研究者と方針決定者との信頼関係を築くようさまざまな努力をした。両者の医薬品からのコスト削減の概算は,年間1400万カナダドル/月(CCB=900万カナダドル/月,ACE抑制剤=500万カナダドル/月)であった。RDPが拡大されるにつれて,反対者からの圧力は増加することは明らかだった。その内容は,ポリシーは不利益であり,削減の概算は達成できないという主張だった。この圧力は,批判者への対応に要する時間を増加させ,ポリシーの実施と開発,また実施のための対策を考案する時間を減少させた。特別権利適用の要請は,1日に300から400送られてきた。医師からの主な批判は,SAフォーム記入やファクス送付など,無報酬の作業が増加したということだった。
さまざまな難問題にもかかわらず,ポリシーは住民や,医師らに徐々に受け入れられるようになった。BC pharmacy associationは,BC Pharmacare改善連合から脱し,行われている評価の手続きはポリシーの拡大についての疑問に答えていると公に発表した。BC
arthritis society は,BC Pharmacare改善連合のメンバーではないと政府に通知した。メディアは,医薬品業界の根強い反対にもかかわらず,ポリシーにより協力的になった。

| 今後の疑問(Questions That Remained) |
RDPのポリシーがカナダにおける医薬品価格の上昇を防ぐことができたか,または今後できるかはまだわかっていない。ブリティッシュコロンビアは特定の参照医薬品のプログラムをもっている唯一の州であるので,国の価格レベルに対する影響は最小であるかもしれない。しかし,一つの治療方法の分類の中での薬品の価格は同レベルになろうとしている傾向がある(たとえば,高血圧のためのアンギオテンシン拮抗薬,偏頭痛のためのトリプタン系薬)。
これまでのRDP実施の段階でいまだ残る疑問は,ポリシーはエビデンスにもとづいており,患者の影響について適切に評価されると,医師らにどのように再確認するかである。
 |
 |
 |
| ■□■ |
新案(Twist in the Track)) |
■□■ |
 |
 |
 |
次の段階は,喘息発作のような回復可能な気管疾患に対する薬であった。これはRDPのポリシーとして始まったが「除外のためのポリシー」に変化し,最後に,Nebulizer
to Inhaler Conversion Programと呼ばれる医薬品転換ポリシーに変化した。これはRDPがすべての呼吸器系の医薬品を管理するよりもNebulizer
to Inhaler Conversion Programが適用されることを望む医薬品業者からの圧力に対応するために作成された。
 このポリシーの作成もまた,用量計量器付吸入器がdrug-delivery devicesであるというわれわれのエビデンスのレビューを反映した。すなわち「喘息発作治療に家庭用湿性ネブライザーを使用することは子供から成人においてまれである。用量計量器付吸入器(MDIs)は,正しい使い方をすればスペースデバイスとともに用いた場合も用いない場合も,比較的低価格であり,軽度から中程度の喘息にはネブライザーと同等の効果がある」57)。また多数の無作為化比較試験もこの見方を支持した58〜61)。さらに地域の多数の病院が,よりよい治療と,経費削減のためにネブライザーを使用した。
このポリシーの作成もまた,用量計量器付吸入器がdrug-delivery devicesであるというわれわれのエビデンスのレビューを反映した。すなわち「喘息発作治療に家庭用湿性ネブライザーを使用することは子供から成人においてまれである。用量計量器付吸入器(MDIs)は,正しい使い方をすればスペースデバイスとともに用いた場合も用いない場合も,比較的低価格であり,軽度から中程度の喘息にはネブライザーと同等の効果がある」57)。また多数の無作為化比較試験もこの見方を支持した58〜61)。さらに地域の多数の病院が,よりよい治療と,経費削減のためにネブライザーを使用した。

| ポリシーとは何であったか? (What Was the Policy?) |
1999年3月1日に実施されたポリシーは噴霧療法のためのネブライザーと溶液補償を制限したが,18歳以下の患者については,自動的に免除された。Pharmacareの補償は,もし患者が以下の条件を満たしていれば特別権利が適用された。
- 患者が認知機能障害をもっており,なおかつMDIとスペーサーの使用が成功しなかったとき。
- 患者が1人で生活しており,重度の上肢運動障害があるか,吸入器の使用に支障をきたす微妙な運動調節障害があるとき。
- 患者が長期治療施設の滞在者であり,1日に最低3回以上の吸入器による治療が必要とされるとき。
- 患者が治療上の効果を得るまでの十分な吸気力がないとき。
ネブライザー利用者の敏感さにより,一つの移行への失敗が,宣伝効果のマイナスにつながることを懸念する声があった。患者にスペーサーデバイスを提供し,薬剤師に患者への指導のための報酬を支払うことが転換をスムーズに進めることであると提案された。薬局へは,患者へ転換のための指導を行うごとに2倍の技術料を支払われた。また患者へは地域の薬局から無料のスペーサーデバイスが提供された。
 保健省のベテランスタッフや職員の交代はポリシー実行に計り知れない損失であった。多くのヘルスケア専門家や患者が喘息のためには噴霧療法が最良だと信じていたため,われわれは早急にエビデンスを明確にすることを迫られた。Policy
Advisory Committee とPharmacare の指導者のコミュニケーションの不足が,ポリシーサイクルの変動をもたらした。諮問委員会の中でのコミュニケーションの不足が「十分な吸気力をもたないために,吸入器による治療効果が得られない患者は,免除の対象である」という内容の誤解を招いた。これは「十分な吸気力がなく,ドライパウダー吸入器から十分な吸気が得られないので治療効果が得られない患者,なおかつMDIの使用に効果がみられなかった患者は,免除の対象となる前に,スペーサーとMDIを同時に試してみるべきである」と解釈されなければならなかった。このような詳細説明の不足が,多数の患者の必要性のない免除に至らせた。
保健省のベテランスタッフや職員の交代はポリシー実行に計り知れない損失であった。多くのヘルスケア専門家や患者が喘息のためには噴霧療法が最良だと信じていたため,われわれは早急にエビデンスを明確にすることを迫られた。Policy
Advisory Committee とPharmacare の指導者のコミュニケーションの不足が,ポリシーサイクルの変動をもたらした。諮問委員会の中でのコミュニケーションの不足が「十分な吸気力をもたないために,吸入器による治療効果が得られない患者は,免除の対象である」という内容の誤解を招いた。これは「十分な吸気力がなく,ドライパウダー吸入器から十分な吸気が得られないので治療効果が得られない患者,なおかつMDIの使用に効果がみられなかった患者は,免除の対象となる前に,スペーサーとMDIを同時に試してみるべきである」と解釈されなければならなかった。このような詳細説明の不足が,多数の患者の必要性のない免除に至らせた。
これらのコミュニケーションの不足とポリシーの結果として生じる問題はポリシーサイクルの大きな変動により明らかにされた。Pharmacareの課題はポリシーの実施のみではなかった。この当時,多数の医薬品プログラムが実施されたが,多くの関係者が複数のプログラムを役割担当することになった。
すべてのRDPポリシーが実施されると,不満を感じていた医師,薬剤師,患者からPharmacareの変更を求める手紙,ファクス,電話が殺到した。また,ネブライザーによる呼吸器の治療は,他の薬品との併用で時間を節約できると考えていた長期治療施設の職員から,ポリシーによって作業が増えたとの抗議が増加した。ポリシーは,3種類以上の治療が同時に行われている場合は,ネブライザーの継続使用を許可した。
18歳以下の患者については,免除が検討された。ブリティッシュコロンビアでは,小児科の患者の割合がネブライザー使用者のなかで最も高く,MDIがネブライザーよりも学齢期の子供の日常的な治療には適しているとされた。もしもポリシーが学齢期の子供を対象に含んでいれば,Pharmacareの費用削減額は大きかったであろう。しかし,Pharmacareは,両親にとって子供の吸入器への転換は困難であると懸念した。RDPの対象に子供を含めることから生まれるわずかな利益は,治療法の転換に失敗した場合に新聞等で公表されるリスクを考慮すると相殺されてしまったため,子供はRDPの前段階で免除された。
医薬品業界からのプレッシャーや圧力は,ポリシーの実施期間には現れなかった。これはおそらく,計量器付吸入器による呼吸器治療が,ネブライザーと同様の効果があると明記した文献が広まったことによる。また,業界も計量器付吸入器はネブライザーと同等かそれ以上の利益を得られるためと考えられる。
 Nebulizer to Inhaler Conversion Programは1年に100万カナダドルの節約となった。ポリシーは無作為化比較試験から始められたため,研究者の共同研究は増加した。約20%の医師とその患者はポリシーに従う群(トリートメントグループ),または6ヵ月の免除を与えられる群(コントロールグループ)に分けられ,それぞれのグループが受ける内容が均等になるように考慮された。無作為化は医師の診療所の住所により行われた。医師らは,主試験責任者(B.C.C)から手紙でPharmacareの6ヵ月の免除期間がすでにPharmaNetに登録されていると通知された。
Nebulizer to Inhaler Conversion Programは1年に100万カナダドルの節約となった。ポリシーは無作為化比較試験から始められたため,研究者の共同研究は増加した。約20%の医師とその患者はポリシーに従う群(トリートメントグループ),または6ヵ月の免除を与えられる群(コントロールグループ)に分けられ,それぞれのグループが受ける内容が均等になるように考慮された。無作為化は医師の診療所の住所により行われた。医師らは,主試験責任者(B.C.C)から手紙でPharmacareの6ヵ月の免除期間がすでにPharmaNetに登録されていると通知された。
予備段階の結果は反対意見者の予想に反して,ポリシーは患者の生活の質や健康状態に影響を与えなかったと証明された。また,薬剤師や医師への6週間前の通達という状況から予想されたように,ポリシーの実施前に膨大な予備在庫が増加した。薬局は,ネブライザーからMDIに転換する際に必要な,患者への新たなカウンセリング費用についてはほとんど請求しなかった。

| 今後の疑問(Questions that Remained) |
われわれは,仮説は確立したものの,将来の医薬品補償を最良のものにするために,どのように試験的なポリシーの結果を活用するかはわかっていない。これは,研究者とポリシーメーカーの共同研究がPharmacareの管理とポリシー発展の溝の中で大きな転換の結果として,弱まったことによる。 |