 |
 |
 |
国立クリニカルエクセレンス研究所(NICE)
(National Institute for Clinical Excellence(NICE)) |
 |
 |
 |
 |
| ■□■ |
ポリシーの論拠(Rationale for the Policy) |
■□■ |
 |
 |
 |
NICEを設立するためのポリシーは,3つの圧力から生じたものである。すなわち,費用に対する圧力増加,過去においてヘルスケアの提供決定が不平等であったこと,治療の質が向上することに対する期待である。さらに国内的にはNHS R&Dプログラムによって,国際的にはヘルステクノロジーの評価によってもたらされたエビデンスをさらに有効利用すべきだという圧力もあった。これらの詳細は,次章にて述べる。
ポリシーの面からみて第1の要因,おそらく最も重要な要因は,前述のように特に薬剤など新しく,そしておそらくは高価な(価格,量的にも)ヘルステクノロジーによってもたらされる費用による(継続的な)圧力であった。
第2の要因は,どのように新薬に対し給付されるかについて,「配給」(rationing)の決定に関し不満が生じていることである。そのような意思決定は地域のHealth Authoritiesに委託されているが,患者の新薬へのアクセスには地域格差が生じ,NHSの大原則である平等性(equity)に反することとなった。これは「郵便番号による配給の違い」(postcode rationing)と呼ばれている。中央政府で決定が行われる場合には,その決定プロセスの場当たり的な部分や不透明性に不安があった。これらの問題は多発性硬化症の治療に対するβインターフェロンと勃起不全に対するバイアグラの使用に関するケーススタディーで別に述べる (ケーススタディー1,2参照)。
第3の要因は,NHSが治療の質を向上させることにいっそう力を注ぐ必要性があることから生じた。政府は,NHSによる治療の向上を政府の方針の最優先事項とするとしている。この政策はブリストルでの小児心臓手術事件をはじめとする一連の医療上の不祥事により,強化促進されることになった4)。
この方針は,「一等席のサービス:質と新NHS」(A First Class Service: Quality and the New NHS)5)に示されており,個別だが関連しあった項から構成されている。
その内容は
・ 患者と一般市民の参加(調査を含む)
・ NICE
・ 国家サービスのフレームワーク
・ 臨床統治(clinical governance)
・ 継続教育と生涯学習
・ 専門家による自己規制(professional self-regulation)
・ 健康改善委員会(Comission for Health Improve-ment)
・ 実施評価フレームワーク
(Performance Assessment Framework,高度な運用指標と臨床上の評価指標)
これらは,つぎの3つの独立した,しかし関連しあう機能を達成するための一連のメカニズムであるとみなすことができる。すなわち基準の設定,その基準の普及と実施,およびその実施と質の効果をモニターすることである(図1参照)。これらの機能は外部の活動(標準設定と外部評価など。ヘルスケア組織に要求される)と,より地域管理される内部活動(地域組織や個々の臨床家のいずれかのレベルで品質の文化を作ることを目的とする)とを組み合わせて実行されている。臨床統治(clinical governance)のような品質向上を志向するものは,これまで英国では行われてこなかった新しい試みである。このような質向上に関する一連の介入は,おそらく世界で唯一のものである。
| 図1 ヘルスケアの質のためのフレームワーク |
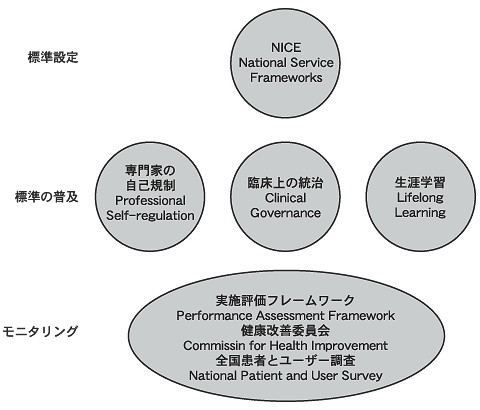 |
品質向上に関する戦略の鍵となるのは,「臨床統治」のシステムにより,提供者側がそれに達しようとする明確な基準の作成を政府がNHSに対し望んでいることにある。専門家の自己規制はまだ存在しているが,質の劣る医療に対し,より効果的に対応するようにという圧力下にあり,NHSの組織は定期的に査察をされることになっている。1999年4月に設立されたNICEは,最善の医療について医療専門家と患者へのガイダンスとして,臨床的なエビデンスと費用対効果に関するエビデンスを用いている。NICEの重要な作業の1つに,新薬やその他の医療技術に対する迅速な評価がある。新製品はNHSの償還を承認されることも,却下されることもあり,また「継続研究が必要」(continuing research)という保留の状態となることもある。
 |
ケーススタディ1.郵便番号による配給の違い(Postcode Rationing)
英国では,インターフェロンベータIb(βインターフェロン)は再発-寛解型多発性硬化症(relapsing-remitting multiple sclerosis: MS)の患者のために1995年12月に認可された。NHS執行部(The NHS Executive)は,処方に関する特定のガイダンスを発行する初めての薬剤として1995年にβインターフェロンを選定し,神経内科医によって適切であると判断された場合にのみ,治療が行われるべきであると勧告した。ガイダンスの目的は処方に関する方針を決定することではなく,医療関係者に意思決定のプロセスについてより多くの情報を提供するためであるとしたため,このガイダンスに関する解釈は関係者の間で大きく異なっていた。
このガイドラインの結果として,MS患者がβインターフェロン治療費用の給付を地域当局に不平等(unfairly)に拒否されたとし(神経内科医はその適切性を評価している),最高裁判所で争われることになった。裁判官は裁決の中で「全面的に禁止(blanket ban)することは,治療によって最大限の利益を得られる患者に対し薬剤を提供するという国家のポリシーに反する」とした6)。それにもかかわらず,βインターフェロンは郵便番号による配給の違いの典型例であり,要求は証明されておらず,費用対効果のよい治療ではないとして,ある地域当局は給付を拒否した。
βインターフェロンの使用に関する最初のガイダンスでは,費用対効果に関する情報(当時,情報は限られていた)の必要性を考慮していなかった。治療は高額であり,1人の患者につき年間約1万ポンドである。1995年の時点で,英国の約8万5千人のMS患者のうち,もしも45%が再発-寛解型MSであり,βインターフェロンの治療を受けるとすると,コストは約3億8千万ポンド,いいかえれば薬剤予算の10%を占めることになる。しかし,βインターフェロンの需要に関する状況は複雑であり,医療関係当局者に臨床試験以外での処方を拒んでいるところもある。
結果として,βインターフェロンは,評価の対象としてNICEに提出された。当初の勧告ではNHSによってカバーされるべきではないとしたが,異議申し立てを受け,さらに研究が進められ現時点では決定は延期されている
。 |
ケーススタディ2.中央政府による配給への不十分なアプローチ(Poor Approach to Central Rationing)
バイアグラ(シルデナフィル)は,勃起不全のために欧州医薬評価局(European Medicines Evaluation Agency: GMEA)によって1998年9月にヨーロッパで認可された。発売に対する高い関心,乱用や要するコストへの懸念の中で,DoHは最終的なガイダンスが準備されるまでバイアグラを処方しないよう英国の医師らに伝えた。これはDoH のStanding Medical Advisory Committeeによって決定された。多数の人々に利益をもたらすことから医薬品としては承認されたもののNHSにより,コストを主たる理由に給付が認められなかった初めてのケースであった。これに対する批判は,バイアグラの処方者や使用を希望する者からのみではなく,配給の原則には全体として支持的であるが,閉じたドアの向こうであいまいな基準で決定するようなことに懸念を抱く人達からでもあった。
その後(1999年6月)に,最高裁判所は,NHSの給付に対する拒否は「医師らの臨床的な判断(clinical judgment)にもとづく義務遂行を妨げる」ため,英国の法律に反するとした。またヨーロッパ法(European law)においても,EU参加国で使用されている薬剤を各国がブラックリストに掲載する決定にあたっては,「客観的で確証可能な基準にもとづいて」その理由を述べなければならないとする,いわゆる医薬品の透明性に関するEU指令に反するとされた。
その後1999年1月に発表されたガイドラインの試案は,1つまたはそれ以上の狭い範囲での適応症に限定にして患者に処方することを認めた。これは明らかな配給を指向するものであった。しかし,ガイダンスは明確な論理に欠けるとして厳しく批判された。たとえば,勃起障害の異なる原因疾患の鑑別は明らかに恣意的であった(たとえば,前立腺切除が原因とされる際には処方されることがあるが,動脈疾患が原因と考えられる場合には処方されないことがあった)。1999年5月,長期間にわたる審議の後,適応症の範囲をわずかに広めた最終的なガイドラインが発表された。
バイアグラの問題は,配給がいまや公の課題であるという,大きな変革をもたらしたが,その問題に対する不十分な対処は,1999年4月に設立されるNICEに大きな影響を与えることになった
。 |
|

知識にもとづくヘルスサービスの構築と研究者との連繋促進
(A Knowledge-Based Health Service-Building on and Extending Collaboration with Researchers) |
|
NICEが設立されたもう一つの理由,もしくは少なくともその設立の促進要因となったのは,前述のようにNHS R&Dプログラムの存在と影響である。意思決定を支援するために,質の高い研究を基にしたエビデンスを得ることが,近年ではNHSの重要な役割となっている。1988年のHouse of Lord Select Committee on Science and Technologyの報告に続き,1999年DoHはNHSの研究と開発に関する戦略を発表した。その目的は研究成果と科学の進歩に関する健全な情報にもとづいて,臨床的,管理的,かつ政策的な決定を行うことのできる,知識にもとづいたヘルスサービスを支えることである。したがって,NHS R&Dプログラムは,ヘルスサービスの必要性に焦点を当てている。
NHSのR&D戦略の重要なものとして医療技術評価(Health Technology Assessment: HTA)プログラムがある。その目的はヘルスケアを使用し,管理し,供給するNHS要員に対し,医療技術に関する費用,効果,そのさらに広い影響に関する高い品質の研究成果の利用を確保することである。毎年,HTAプログラムとその委員会は,NHSとそのユーザーによる提案の中からどの研究を優先させるかを決定する。その中のテーマから生じる疑問点に答える研究計画を公募し研究を委託する。リサーチの結果は,HTAモノグラフシリーズとして公表されている。(http://www.ncchta.org/htapubs.htm)
HTAプログラムの存在とNHS R&Dプログラムの力と文化は,NICEの構成,運用方針とくに医療技術に関する情報をとりまとめる手法について重要な役割を果たした。NICEはHTAプログラムに評価作業を委託しており,それらはNICE評価委員会(Appraisal Committee,臨床的有効性と,費用対効果のエビデンスのレビューに責任を有している)により活用されている。言い換えると,HTAプログラムは何よりも,NHSに助言するためにNICEが必要とするエビデンス,知識,方法が入手できる手段を確保しなければならない。評価委員会(Appraisal Committee)の仕事をサポートする他のエビデンスは,NICEにより,医薬品業界,保健専門家,その他の関心ある団体から得られるものである。
R&D プログラムとNHSの執行部は,研究結果が国家の勧告やガイドラインとして明確に反映されることにより,研究成果が実地臨床に伝えられる(inform)可能性が増えるだろうと考えた。特にヘルスケア研究とNHS R&Dプログラムの緊密な連携や,NICEの活動と他の質向上のための部門,たとえばNational Service Frameworksは,ポリシーと研究の間に強力で新しい関係を築く可能性を与えている(図2参照)。
| 図2 NHS R&DプログラムとNICEの関係 |
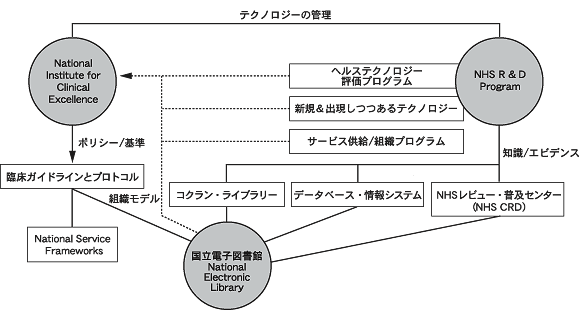 |
NICEが評価すべき医療技術を同定し,ガイドライン発行までの時間的スケジュールに同意したのち,HTAプログラムはNICEと契約を結んだ評価報告書作成グループの間の仲介役となる。HTAプログラムは,下記の点につきNICEおよびレビューグループとのリエゾン(liaison)役を行う。
| ・ |
評価報告書(Assessment report)を作成するのに最も適したグループを決定する。 |
| ・ |
NICEに代わり正式に作業を依頼する。 |
| ・ |
グループの有する利害関係(conflict of interest)を明らかにするために,書類作成,レビューを行う。 |
初年度に,全国的な学術センターネットワークがバーミンガム,シェフィールド,サウザンプトン,ヨークの各大学により設立された。これらは正式な契約のもとにNHSの中で優先順位が高い医療技術について年間40までの至急評価を行うことになっている (http://www.ncchta.org/nice.htm参照)。これらの迅速評価(rapid review)は,同意されたフォーマットで,3ヵ月〜6ヵ月という短期枠(ほとんどのヘルステクノロジーに関する評価より短い)に作成される。図3は,埋め込み型電気細動除去器の評価に関して,大学との共同作業がどのように行われたかを示している。
| 図3 大学,HTAプログラムとNICEのリンク |
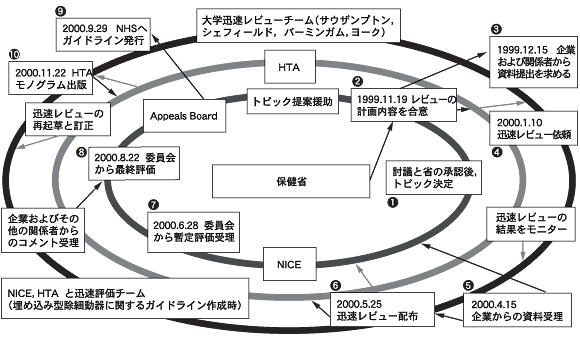 |
NICEの業務予定に対応するには,年間約40の“迅速レビュー”が必要である。これらの例としては,以下のものが含まれる。智歯の抜歯の適応,臀部プロテーゼ法,卵巣がんや乳がんに対するtaxanes療法,子宮頸部スクリーニングのための体液による細胞診,運動ニューロン疾患に対するリルゾール治療について,自家軟骨移植,不安定狭心症や冠動脈疾患とグリコプロテインIIb/IIIa受容体作用薬,多発性硬化症に対するβインターフェロン治療,アルツハイマー症に対するドネペジル,リバスチグミン,ガランタミン治療について,関節炎に対するCOX II阻害薬治療についてなどがある。NICEへの提出に続き,HTAプログラムは,レビューグループによる評価報告をHTAモノグラムシリーズに発表する。これらの報告は,関連するNICEガイダンスが発表される前に発行されてはならない。
NICEの設立により,研究者とポリシーメーカーが共同作業をする機会が増えた。大学により運営されているHTAは,NICE評価委員会の意思決定の根拠として直接的に利用されている。研究とポリシーの直接的な連携は極めてまれである。しかし,いくつかの問題もある。第一に,NICEにより求められている過密なスケジュールは,自らの報告の質に関する不安を研究者に与えることになる。第二に過密なスケジュールや機密性を保持しながら,状態への介入よりもむしろ,独立したテクノロジーに焦点をおくことで,研究結果を高レベルの雑誌に掲載する機会が減ることになる。研究内容を発表することは,研究者の学術的功績の生命線であり,発表の機会が増加しない限り,研究者はHTAプログラムに継続して参加しようとしないことが予想される。最後に,ヘルステクノロジーの評価を高い水準で行うのに必要な訓練を受け,十分な能力をもつ研究者の数は少ないことがあげられる。NICEによる迅速評価の要求は急速に増加している。それとともに,製薬会社が,NICEへ症例を提出する準備を行う能力のある研究者を必要としている状況もあり,研究者の不足が明らかになっている。これは早急に対応できるものではなく,すでに多忙である研究者の作業量を一層増すことになった。研究能力の限界は,NICE設立時には予想されていなかったが,対処が必要である。
NICEを設立したポリシー上の理由をまとめると,
| ・ |
客観性:政治的影響のないことが明らかにわかる方針決定が必要である。このことによりポリシーメーカーを,相反する面のある困難な決定の場から“隔離”し,同時に彼らにも医師のサポートと尊敬をもたらすことになる。 |
| ・ |
実行の統一性:臨床効果のみでなく費用対効果も考慮に入れ,最新のエビデンスにもとづいたテクノロジーの合理的使用に関するNICEの意思決定は医療関係者とNHSにより受け入れられた。 |
| ・ |
R&Dプログラムとの連携:これは,現状のHTAの最重要課題であり,HTAは今まで普及のための明確な戦略および政治と医療間の具体的な連携手段を有していなかったことによる。NICEのガイドラインと勧告は,National Service Frameworkのガイダンスとともに,リサーチエビデンスを医療の実践に導入するひとつの方法と考えられている。 |
| ・ |
NHSのためのより多くの財源確保:あらたな資金が医療効果と費用対効果のある方法のために利用されていると示すことができれば,公共資金に関する政府の各部門間の競争でも強いカードをもっていることになる。NICEのための財源(テクノロジー評価のために用意されたもの,すなわちレビューと経済評価のための費用の約半分を含む)は,すでに確保されている。NICEは,投資以上に大きな効果が期待できる機関であるとみなされている。
|

| NICEの政策確立と実施方法(Establishing NICE Policy and Mode of Operation) |
NICEは,イングランドとウエールズのNHSのために活動しており,1999年4月1日にヘルスケアの公共機関として設立され,1999年から2000年にわたり1060万ポンドの予算を確保した。この予算は2001年から2002年には1260万ポンドに増額される予定であるが,これは勧告とガイダンス普及およびヘルステクノロジー評価と医療ガイドラインプログラム拡大のために必要とされる資金も考慮したものである。NICEの役割は,イングランドおよびウエールズのNHSの医師に対して,疾患の管理,新規または既存のテクノロジー利用に関するガイダンスを提供することにある。またNICEは,患者と介護者向けのガイドラインを作成することも要請されている。
わずかな予算(約100万ポンド)が英国全体の新規テクノロジーに対する評価費用に充てられており,残りは他のガイダンス作成と活動資金に充てられている。
NICE会長(chairman)であるMichael Pawlinsは「NICEはNHSによる医療サービスの質向上を目的とする。NICEはこれを実行するために3つの手段を用いる。つまり,NHSにおいて新薬と技術が費用対効果をもっているかという評価を行うこと,医師,介護者,患者のためにガイドラインを作成し普及させること,医療監査の発展と促進に努めること,である」と述べた7)。当時の保健長官Frank Dobsonは,端的に,「(NICEは)もみがらから小麦をより分ける作業を行う,つまり旧式で非効率的な処置から患者を守り,NHSが患者によりよい仕事を行うことを可能にする」と述べた。この際に示されたNICEのもう一つの目標は,質と価格に対する異なる解釈から生じた,ヘルスケアの地域格差を減少させることである。
“Faster Access to Modern Treatment: How NICE Appraisal Work8)”には,臨床効果と,費用対効果に関するガイダンス作成と技術の評価をどのように行うかについて詳述されている。NICEのガイドラインでは,企業/製造者が目的,価格,臨床効果と費用対効果の詳細についてNICEの要請後12週間以内に提出するよう求めている。現在,新薬の評価は特に難しい。なぜなら新薬は比較的に少数の臨床効果をみる試験により評価が行われており,患者に対する有効性については不明確な点がしばしば認められるからである9)。試験結果は,薬剤が発売された後に発表されることもあり,すべてのアウトカムについてデータが十分でないこともある。したがって,製薬会社に未発表のデータの提出を求めることは重要である。
レビューのためのデータは,製薬会社から入手する場合と同様に公的(public domain)にも入手可能である。NICEは製薬会社に関連あるすべてのデータの提出を要求する。NICEは製薬会社にデータを提出したことを文書として残すことを勧めており,その対応としてNICEは企業秘密を第3者に漏らすことがないことを確約する。NICEは評価,ガイドライン作成いずれの場合にも製薬会社に関連データを提出するよう強制する法的権限はもっていない。この点が新薬の安全性,効果,質を判断するために,関係するすべてのデータの提出を法的に強制できるMedical Control Agency(医薬調整局)と異なっている。
ほとんどの評価においてこれまでNICEは,必要とするデータにアクセスすることは可能であった(とはいえ,すべてのデータを使用できていたかは知りようがないが……)。1,2件のケースでNICEが匿名の症例データ提出を要請しても,拒否されたこともあった。しかしNICEは,製薬会社に情報提供をするように法的手段を行使することはない。
NICEによる審査結果が保健長官,あるいはウエールズ議会により最終決定されるということは,NICEの独立性を損ない,NHSおよび社会からの信頼性に影響するかもしれない。これまでに22件がNICEによる審査が必要であると発表されたが,そのうちの11件は薬剤であり,インフルエンザに対する新薬や,再発—緩解性多発性硬化症の患者に対するβインターフェロンを含んでいた。最初の評価は抗インフルエンザ薬であるザナミビルに対するものであった。
NICEによって行われる評価は,一般的に医薬安全委員会(Committee of Safety in Medicines)による承認後に行われ,承認とは異なるものであることは強調されるべきである。医薬品の承認決定は一般に安全性と効果にもとづいて行われる。しかし薬剤に対して公的資金を用いるか否かの判断は,臨床効果や費用対効果など,患者の生活の質に与える影響や,入手可能な同効薬の価格との関連で決定されるのである。
 |
 |
 |
| ■□■ |
政策開始の理由:リレンザの評価 |
|
| |
(Why Was the Policy Initiated? The Relenza Appraisal) |
■□■ |
 |
 |
 |
リレンザはNICEに提出された最初のヘルステクノロジーである。ザナミビル(リレンザ)は,インフルエンザの症状を抑え,回復を早める薬剤として認可された11)。冬期およびインフルエンザが流行するシーズンの前にNHSにおいて準備を行う必要性があることから,NICEは特別にファスト・トラック(fast-track appraisal) による評価を行い,報告書を保健大臣に提出するように要請された。約3ヵ月を要するファスト・トラックによる評価はアプローチと時間的な面で通常の評価手順と異なっていた (ファスト・トラックのプロセスに関する詳細は http://www.nice.org.uk/nice-web/Cat.asp?c=426参照)。通常評価は終了するまでに10ヵ月から12ヵ月を要する(詳細はhttp://www.nice.org.uk/参照)。
“Faster Access to Modern Treatment”8)において認められている迅速評価(rapid appraisal)の使用は,NICEのオプションとして受け入れられている。リレンザの評価は,NHSにとって有意義であると同時に,NICEにとっても技術の評価や組織を構築する原則を試みるよい機会であった。
NICEはその最高責任者であるAndrew Dillonを議長に,秋冬のインフルエンザ流行前に薬剤についての予備的なガイダンスを作成するために,短期の迅速評価委員会を設けた。委員会は1999年9月に2回開催され,2回目の委員会には製造者であるGlaxo Wellcomeの代表も招いた。1999年10月,NICEはNHSのリレンザ使用に反対する決定を下した。NICEは企業による臨床試験結果からは,インフルエンザ以外には病気のない健康な個人において必要とするコストは明らかでなく,中等度ほどの効果,症状を1日間短縮する程度のエビデンスしか存在しないと判断した。ザナミビルに関する議論の中心は,高齢者,喘息患者,慢性呼吸器疾患患者のような高リスク患者に対しても薬剤が効果的であるか,生命を救うことができるかということが,臨床試験で証明されているか否かであった。高リスク患者に対する効果に明確なエビデンスが存在しないため,NICEはGPに対して,1999年〜2000年のインフルエンザの流行時期にザナミビルを処方しないよう勧告した(付録1,2参照)。
NICEの決定に関し評価を受けた製薬会社には,中間ガイダンスが保健長官に提出される前に委員会へ異議を申し立てる権利がある。Glaxo Wellcomeは異議を申し立てたが,決定を覆すことはできなかった。
これが,NICEによる初めての勧告であり,意思決定の基準,コストの役目,NICEと保健長官の方針決定に医師がどの程度従うべきなのか,などの重要な問題を喚起した。現実的には,NICEの勧告に法的な根拠はない。しかし,NICEの倫理性,学問上の権威,さらにひきつづいて保健長官により決定される保険の給付は,法律的なものであることから,専門家はこれらの勧告に従うことが望まれている。
保健長官とウエールズ議会大臣は,NICEの助言を受け入れ,NHSの医師向けのガイダンスを発行するよう要請した。これは処方を禁止(ban)することを意味するものではない。なぜなら医師らは患者個人の状態に応じて,自分自身の医学的判断を下す責任があるからである。しかし医学的判断を行う際には,NICEのガイダンスを考慮することが求められている。NICEはインフルエンザの予防接種が合併症予防に最も効果があるということを勧告した。ワクチン接種率は,今もなお低いが,2000年初秋から65歳以上の人や,高リスクの患者に対して接種を行う場合には,GPは1回の接種ごとに料金を受け取れるようになった。
NICEはGlaxo Wellcomeが行う高リスク患者に対するザナミビルの臨床的効果および費用対効果のエビデンスを得るための試験に,NHSが実践的協力をすることを提案した。NHSはGPのリサーチネットワークとインフラをGlaxo Wellcomeに提供するという方法で,援助することに同意した。
NICEは2000年〜2001年の冬期のインフルエンザ流行の前に,ガイダンスの見直しを行った。これは1999年10月の迅速評価終了時に,NICE自身が行うことを決めていたもので,製薬企業がさらに臨床試験を追加し,また薬剤がプライマリ・ケアの仕事量にどのように影響するかを検討する試験を行いたいとしたことを受けたものである。
既存データの見直しおよび新しい試験結果を含む改訂報告書が製薬会社から提出され,NICEはこれらを全く新しい評価としてレビューを行った。この新しい試験は,リスクを有する患者に対する薬剤の効果を検討している(trial reference NAI30008)。
この新しい試験データはリレンザを審議する最初のミーティング終了時までには評価委員会に提出されなかった。製薬会社と,患者,専門家グループが含まれたミーティングでの仮決議では,既存のガイダンス(1999年10月)の変更は提案されなかった。このことは重要である,なぜならば前回の迅速評価委員会のメンバーの少数が新しい評価委員会に重任していたのみで,両者の構成が異なっていたにもかかわらず結論が同じだったからである。すなわち今回の評価委員会は前回の迅速評価委員会の結論を「認証」(validate)したのである。2回目の会議では評価委員会はバーミンガム大学の学術研究チームによって作成されたNAI30008トライアルのレビューと既存の試験における高リスク群をプールした解析結果を評価資料として用いることができた。このレビューでは,リレンザは,統計学上はボーダーラインの有意性であるものの,高リスクグループ患者の合併症を減少させることにより,入院数や死亡数を減少させるエビデンスがあると結論していた。評価委員会は下記の重要な点を含む改訂版ガイダンスを発行するようにNICEに勧告した。
| ・ |
インフルエンザの症状を有する以外には健康である人へのザナミビルの使用はすすめられない。 |
| ・ |
ザナミビルの使用はインフルエンザが地域的に流行している場合に,危険 因子を有する成人患者のうちインフルエンザ様症状(ILI)が現れてから36時間以内で,ILIが現れてから48時間以内に治療が開始できる場合に推奨される。
危険因子をもつ成人患者とは下記のうち,1つ以上の項目が該当する者を指す。 |
| ・ |
65歳以上 |
| ・ |
定期的薬物治療を要する慢性呼吸器疾患(COPD,喘息を含む)患者 |
| ・ |
重篤な心血管疾患患者(高血圧は除く) |
| ・ |
免疫不全 |
| ・ |
糖尿病 |
地域的にインフルエンザが流行していることを示すには,その地域のウイルス調査プログラムが使用されることが望ましい。
インフルエンザに罹患する可能性が高い危険因子をもつ成人患者に限定してザナミビルを使用することが,この治療の臨床効果と,費用対効果を最大限にするために必要不可欠である。
この改訂されたガイダンスはNICEにより2000年11月に発行され,2002年11月に再び改訂される予定である。
 |
 |
 |
| ■□■ |
ポリシーに対する支持者と批判者 |
|
| |
(Who Was for the Policy, and Who Opposed It?) |
■□■ |
 |
 |
 |
| ポリシーとしてのNICE(NICE as Policy) |
全体的にNICE設立に対する批判はわずかである。NHSの多くのものは,ヘルステクノロジーの使用に関する国家レベルでのリーダーシップとガイダンスを望んでいた。またその期待はNHSが質に関する問題に取り組むためのより大きな戦略の一部でもあることから支持されていた5)。特にヘルステクノロジー評価に関る研究分野の人々も,評価作業,ポリシー,実地医療を相互に結びつける手段となる,という観点から,NICEを支持している。しかし,研究者らは,評価の方法論と評価プロセスの質について懸念を表明している9)。医薬品業界は,NICEの役割,意思決定の方法,NICEの勧告内容の位置づけに対して少なからぬ疑問を抱いていた。製造者側の専門家と研究者らはNICEをヘルスケアの取り組みにおける合理性を増すための手段というよりは,単に費用コントロールのメカニズムと考えていた。

| リレンザのポリシー(Relenza as Policy) |
評価はいずれにせよ順調に進むであろうと考えた製薬企業のGlaxo Wellecomeと,DoHは評価に同意した。製薬会社は,ファスト・トラックによる評価に限界があることから,この申請に対する評価も現実的な視野から行われると確信していた。

| リレンザのポリシー実行の過程(History of Implementing the Policy on Relenza) |
当初からポリシーはGPや議員から支持されていた。処方価格評議会(prescription pricing authority, PPA)の1999年から2000年冬期のリレンザ処方に関するデータからも,リレンザの処方数が少ないことが明らかで,勧告が守られたことがわかった。しかし,以下の点に関して,製造会社から強い批判が寄せられた。
| ・ |
審査過程と異議申し立てのスピード |
| ・ |
審査を行う専門家の場当たり的な(adhoc)選択方法 |
| ・ |
評価委員会に提出される情報に対するガイドラインの欠如 |
| ・ |
社会的利益に対する関心の明らかな欠如。たとえば,追加作業により増加する仕事量や新しい技術がNHSにもたらす費用面での利益など |
| ・ |
当初からプログラムで検討するようにデザインされていなかったサブグループ解析への関心 |
これらのうち,最後の問題については特に関心がよせられた。なぜなら,ザナミビルの保険給付についてNHSの議論は,高齢者や慢性呼吸器疾患のような高リスク患者における薬剤効果に集中していたためである。しかし,試験データには高リスク患者は,少数例しか含まれていなかった。一般に試験は,できる限り広い範囲から患者を集めて行われることが理想とされるが,ザナミビルのケースでは高リスク患者群が必要とされた。それは,この群で効果があるのならばNHSにとって最も費用対効果と価値の高いものとなるからである。これは薬剤の評価にあたり,方針決定をどのように行うべきかについて問題を提起することとなった。また,R&Dとマーケティングにかかわっている者が,エビデンスにもとづくアプローチを行っているヘルスサービス側と規制側が必要とする情報について十分な意識をもっていない可能性がある。NICEおよび他の国々でのNICEに類する機関のプロセスにより費用対効果,経済性,対象集団の重要性が増大し,これらは第III相試験のデザインにも影響を与えることになろう。
薬剤の不評は英国外でのリレンザの販売に悪影響を与えることから,製造会社の懸念は高まっていた。世界各地,たとえば米国のマネージメントケアグループや,日本の規制当局などから関心を示されていた。強い関心が集まる中で,製薬会社はNICEの英国における研究開発に関する評価が長期的に及ぼす影響,たとえば医薬品業界が英国ではなく外国で新薬を開発,申請を行うようになることなどについて懸念を示した。これらの懸念は,総理大臣がPharmaceutical Industry Competitive Taskforce の設立に資金提供を決定する際の重要な要因となった。しかしながら,1年後のリレンザの改訂ガイドラインの発行は,逆の反応を引き起こした。製薬会社は,ガイダンスには満足であり,異議申し立てをしなかった。しかし,処方を行う側のGPの反応は異なっていた。GPの代議員(national representative)はガイダンスに対して異議申し立てをしなかったものの,評価委員会の新しい試験にもとづくエビデンスの解釈は不十分である,との疑問を示した。しかしGPの主な懸念は,冬期の緊急時の対応が時間的に不十分なままに終わってしまうことにあった。これらの懸念に対応するために,保健省はhealth authorityにPatient Group Direction, PGDを使うように求めた。PGDとは地域看護師や地域薬剤師が指定された薬剤を,特定の患者グループに処方することを認めるものである。この場合,特定の患者グループとはNICEのガイドラインで示されたリスクをもつとされるカテゴリーに属する人である。それにもかかわらず,GPは改訂ガイダンスを以前版よりも歓迎していない。
 |
 |
 |
| ■□■ |
実行された政策の評価 |
|
| |
(Evaluation of the Policy as Implemented) |
■□■ |
 |
 |
 |
NHS自身の質の評価は,これまで行われていない。しかしNICEガイダンスの普及とその影響に関する研究は2001年6月に募集が開始された。Commission for Health ImprovementとMedical Royal CollegesはNICEガイダンスの実行を監督するように命じられたが,今のところまだデータは作成されていない。
 リレンザのガイダンス評価はこれまでに,発表されていないが,冬期のリレンザの処方率は低く,NHSでの処方数は合計で212,合計コストはわずか5,544ポンドであった。医療関係者らの批判の一つに,NICEの決定には法的権限が与えられるべきであった,というものがある。薬剤を「ブラックリスト」に収載できないことは,患者の要求からGPを保護できないことになると考えられる。NICEの勧告が他のガイドラインよりも大きな影響をもつためにはどうすればよいか,スコットランドと北アイルランドのNHSガイダンスとの矛盾にどう対応するかについては今後の状況をみる必要がある。ガイドラインは強制ではなく,個々の裁量でヘルスケアサービスへの最終的な決定を行うことになろう。医学的裁量が批判を受けることはないが,ガイダンスはすべての人に受け入れられることが望まれる。相反する問題がどのように解決されるかに関してはまだ不明確である。
リレンザのガイダンス評価はこれまでに,発表されていないが,冬期のリレンザの処方率は低く,NHSでの処方数は合計で212,合計コストはわずか5,544ポンドであった。医療関係者らの批判の一つに,NICEの決定には法的権限が与えられるべきであった,というものがある。薬剤を「ブラックリスト」に収載できないことは,患者の要求からGPを保護できないことになると考えられる。NICEの勧告が他のガイドラインよりも大きな影響をもつためにはどうすればよいか,スコットランドと北アイルランドのNHSガイダンスとの矛盾にどう対応するかについては今後の状況をみる必要がある。ガイドラインは強制ではなく,個々の裁量でヘルスケアサービスへの最終的な決定を行うことになろう。医学的裁量が批判を受けることはないが,ガイダンスはすべての人に受け入れられることが望まれる。相反する問題がどのように解決されるかに関してはまだ不明確である。
ガイダンスが示された後の,医薬品業界(評価のためのコストを負担する部分である)の影響は無視できない。特に市場へのアクセスが厳格に制限される場合には,ガイダンスは法的に提訴される可能性がある。バイアグラのケースでもみられるように,提訴が成功に終わった場合,DoHによって法令が下されることもありうる。提訴が不成功に終わっても長期的にはガイダンスが不確実なものとなり,NICEの有用性を損なう可能性がある。この新しい評価プロセスは製品の商品価値を減じ,医薬品業界に英国で製品を評価申請することに意義はないと思わせる可能性がある。これは,EUレベルでNICEのような組織を構築する一つの理由となる。

ポリシーメーカーと研究者のコミュニケーションについて
(Issues of Communication between Policymakers and Researchers) |
Glaxo WellcomeとNICEの間のコミュニケーションは良好なものであった。Glaxo WellcomeはNICEにすべてのデータを提供し,それは会社にとっても最も大きな利益となった。Glaxo Wellcomeは,評価のプロセスに関し,特に時間的な制限と異議申し立てのために与えられた時間の短さについて懸念をもっていた。そのため,Glaxo Wellcomeにはガイダンスの草案が提供され,迅速評価委員会(Rapid Appraisal Committee)に意見を述べるための機会が与えられた。
しかし,それは製薬会社にとり「裏切られ(let down)」,見せかけの再評価を与えられたように感じさせるものであった。これは医薬品分野が,ゲームのルールが変わったことをはっきりと認識していなかったことと,ドアの向こうでのこっそりとした交渉によって決定されるような体制のプロセスではなかったことが原因である。たとえば,Glaxo Wellcomeは,ファスト・トラックに提出する資料内容についてNICEのメンバーと議論のうえ同意したが,評価委員会の側では最終的な分析にあたり,企業の全体的な作業姿勢と,事前に同意を得たはずのプロセスが企業に対して特別な影響力をもっていなかったことに大きな懸念をもっていた。
第二に,ファスト・トラック評価プロセスのスピードは双方にとって非常に困難をもたらした。たとえば,与えられた短時間の枠の中で,評価委員会が入手したすべての情報を使用しているのかすら確かではなかった。
また,Glaxo Wellcomeは十分な説明のないまま,追加情報を提出するよう求められ,個々の社員に大きなプレッシャーが与えられた。しかも,その情報がプロセスに必要不可欠なものであるかどうかは不明であった。Glaxo Wellcomeは評価委員会に対して意見を直接述べる機会(以降のレビューでは許可されなかった)を与えられたが,レビューのうえで問題になっている重要な部分について企業に理解を与えるものではなかった。
 最初の研究およびその後の研究は,製造会社から資金提供を受けている。NICEは評価や審査に関する資金を提供し,NICEはDoHおよびウエールズ議会から直接資金を受けている。
最初の研究およびその後の研究は,製造会社から資金提供を受けている。NICEは評価や審査に関する資金を提供し,NICEはDoHおよびウエールズ議会から直接資金を受けている。
 |
 |
 |
| ■□■ |
NICEの現状 (Current Status of NICE) |
■□■ |
 |
 |
 |
NICEの評価プログラムは完成した(詳細はhttp://www.nice.org.uk/.)。2000年1月現在,9種の評価が終了し,年間50種の評価を18項目のクリニカルガイドラインとともに作成することを目的にしている。 |